| L'atome et
l'électron
Fractionner une goutte d'eau en deux parties
aboutit à deux gouttes d'eau plus petites. Mais il arrive un moment où la plus
fine goutte est constituée d'une seule molécule et couper cette molécule en deux
fait que l'on se trouve en présence non pas d'eau, mais des constituants de la
molécule d'eau : un atome d'oxygène et deux atomes d'hydrogène.
La molécule
La matière, qu'elle soit solide, liquide ou
gazeuse se compose de molécules qui sont des groupements d'atomes. Par exemple
le chlorure de sodium, le vulgaire sel de cuisine, est formé d'un atome de
sodium et d'un atome de chlore. Le chlore et le sodium sont deux éléments
simples, au même titre que l'hydrogène ou l'oxygène. Les molécules du gaz
hydrogène sont formées de deux atomes d'hydrogène. Le symbole chimique de
l'hydrogène en tant que gaz est H2,
le chiffre 2 indiquant la présence de deux atomes H. Les associations d'atomes
pour former des molécules sont soumises à des lois très strictes, imposées par
la structure même des atomes mais il existe une quantité énorme de possibilités
d'associations.
L'atome
En tant que plus petite partie d'un corps,
l'atome a été imaginé déjà dans l'Antiquité. Mais c'est seulement au 19ème
siècle qu'il put être étudier et modélisé. On doit à Ernest Rutherford, un
physicien anglais d'avoir proposé la représentation de l'atome sous la forme
d'un système solaire miniature. Alors que le nombre de molécules possibles nous
parait infini, le nombre d'atomes est limité. Dans la nature on ne trouve pas
plus de 92 corps simples différents. Alors qu'il est possible de fabriquer des
molécules visibles avec un microscope électronique, l'atome a des dimensions qui
sont de l'ordre de grandeur de l'angström.
Les corps simples les plus courants sont stables : un atome de cuivre restera
éternellement un atome de cuivre. Par contre les atomes les plus lourds, comme
le radium ou l'uranium, peuvent se désintégrer et donner naissance à un ou deux
autres atomes. Ainsi le radium peut se transformer en radon, un gaz rare
radioactif. Ces transformations sont exploitées dans le domaine de l'énergie
nucléaire.
remonter
La structure de l'atome

Conventionnellement on représente l'atome comme constitué d'électrons gravitant
autour d'un noyau, comme le feraient des satellites autour d'une planète. Par
rapport au diamètre de l'atome, le noyau semble très petit, la matière est
essentiellement constituée de vide.
Le noyau est constitué de nucléons :
- un nombre Z de protons, déterminant la nature du corps simple.
- un nombre N de neutrons.
Z est le numéro atomique. L'oxygène qui comporte 8 protons a un numéro
atomique 8.
Le nombre de masse A est égal à la somme Z+N, il est de 16 pour
l'oxygène. Pour les noyaux lourds N est plus grand que Z (voir plus loin les
isotopes) ; exemple : le cuivre A = 63, N = 29, Z = 34.
La charge électrique du neutron est nulle. Le proton a une charge positive égale
en valeur absolue à celle de l'électron qui lui, est négatif. A son état normal
un atome est neutre, le nombre d'électrons étant égal au nombre de protons. Sur
la figure ci-contre les neutrons du noyau n'ont pas été représentés.
L'essentiel de la masse de l'atome est concentré dans le noyau.
Voir : les dimensions de l'atome
remonter
25.01.2012 20:56:02
Répartition des électrons
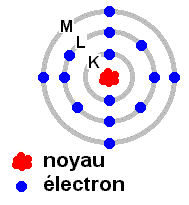 Les électrons,
de charge négative, sont répartis par couches. Chaque couche ne peut comporter
qu'un nombre limité d'électrons. Par exemple la couche K qui est la plus proche
du noyau est saturée avec 2 électrons. La couche la plus à l'extérieur de la
plupart des atomes n'est pas complète, elle peut ainsi accepter (provisoirement)
des électrons, ou éventuellement en perdre. C'est le cas lors de l'ionisation
d'un atome. Les gaz rares (hélium, néon, krypton...) ont la couche la plus
extérieure qui est saturée, ils sont inertes sur le plan chimique. Les électrons,
de charge négative, sont répartis par couches. Chaque couche ne peut comporter
qu'un nombre limité d'électrons. Par exemple la couche K qui est la plus proche
du noyau est saturée avec 2 électrons. La couche la plus à l'extérieur de la
plupart des atomes n'est pas complète, elle peut ainsi accepter (provisoirement)
des électrons, ou éventuellement en perdre. C'est le cas lors de l'ionisation
d'un atome. Les gaz rares (hélium, néon, krypton...) ont la couche la plus
extérieure qui est saturée, ils sont inertes sur le plan chimique.
Le nombre d'électrons maximum par couche est le suivant :
K : 2, L : 8, M : 18, N : 32, O : 50...
La figure ci-contre représente dans un plan les 14 électrons d'un atome de
silicium gravitant autour du noyau composé de 14 protons et 14 neutrons.
Les ions
Une molécule de potasse, d'acide sulfurique ou de chlorure de sodium se dissocie
en ions lorsqu'elle est dissoute dans de l'eau. Par exemple, la molécule NaCl
devient Na+ et Cl- L'ion Na+ est appelé cation car il sera attiré par la cathode
négative lors d'une électrolyse et l'ion Cl- est un anion. Le symbole Na+
signifie que l'atome de sodium a perdu un électron et possède une charge
positive tandis que l'anion Ca- possède une charge électrique positive.
L'ionisation peut se produire aussi à haute température. Un plasma est un gaz
complètement ionisé, un mélange d'ions et d'électrons dont la charge globale est
neutre.
Les gaz de la haute atmosphère (l'ionosphère) sont ionisés par le rayonnement
solaire. Il participent à la formation de couches réfléchissant les ondes radio
sur ondes courtes.
remonter
Le rayonnement
Les électrons périphériques sont moins fortement
soumis à l'attraction du noyau que ceux des couches internes et il arrive
fréquemment qu'un électron change d'orbite par suite d'une excitation comme, par
exemple, une décharge électrique en milieu gazeux. Lors de cette opération
l'électron absorbe une certaine quantité d'énergie. En reprenant sa trajectoire
normale, l'électron restitue l'énergie W (en J) qu'il avait absorbée en
émettant un photon, donc un rayonnement de fréquence
n
(en Hz) particulière selon la relation :
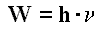
avec h = 6,6256.10-34
J.s (constante de Planck). Voir : fréquence des radiations
lumineuses.
Réciproquement, un photon capté par un atome peut provoquer un changement de
trajectoire d'un électron et faciliter le passage d'un courant électrique (effet
photoélectrique) voire ioniser l'atome en éjectant l'électron.
Les isotopes
Deux atomes d'un même corps simple comportent le
même nombre de protons dans leurs noyaux respectifs. Mais le nombre de neutrons
contenus dans le noyau peut varier. Ainsi le noyau d'un atome d'hydrogène
ordinaire est composé d'un seul proton mais il existe aussi deux autres sortes
d'hydrogène :
- le deutérium, dont le noyau est composé d'un proton et d'un neutron
- le tritium, qui possède deux neutrons dans son noyau.
Ces trois atomes sont des atomes d'hydrogène dont les propriétés chimiques sont
identiques. On donne le nom d'isotope aux différentes variantes d'atomes d'un
même corps simple. L'uranium possède 3 isotopes naturels dont le plus courant
est l'uranium 238 dont le noyau est constitué de 92 protons et 146 neutrons.
Les isotopes radioactifs peuvent avoir des applications pacifiques dans le
domaine médical.
Le cristal
La couche la plus externe de l'atome abrite les
électrons qui participe à la conduction dans les corps conducteurs comme le
cuivre, l'aluminium ou qui permettent l'assemblage d'atomes comme dans les
molécules ou les cristaux.
Un cristal est un solide formé d'atomes régulièrement disposés et fermement liés
les uns aux autres. Il peut s'agir d'atomes différents (chlore et sodium dans le
sel de cuisine) ou identiques (carbone, dans le diamant). Les atomes voisins
mettent en commun leurs électrons de la couche externe.
Dans le cristal de silicium, chaque atome est lié à 4 atomes voisins avec qui il
partage les quatre électrons de sa couche M. La répartition étant régulière on
peut considérer qu'un atome est au centre d'un tétraèdre et que ses 4 voisins
sont placés aux sommets de ce tétraèdre.
remonter
Tableau périodique des éléments de Mendeljeev
Sélectionnez un élément et vous
naviguez vers les informations développés et un choix pour plus d'infos.
|